Od početka vremena, ljudska bića nastojala su shvatiti od čega se sastoji svemir i sve unutar njega. I dok su drevni magi i filozofi zamišljali svijet sastavljen od četiri ili pet elemenata - zemlje, zraka, vode, vatre (i metala ili svijesti) - od klasične antike, filozofi su počeli teoretizirati da je sva materija zapravo sastavljena od sićušnih, nevidljivi i nedjeljivi atomi.
Od tog vremena, znanstvenici su sudjelovali u procesu neprekidnog otkrivanja atoma, nadajući se otkriti njegovu pravu prirodu i sastav. Do 20. stoljeća naše je razumijevanje postalo rafinirano do te mjere da smo uspjeli konstruirati točan model toga. I u proteklom desetljeću naše je razumijevanje još više napredovalo, do te mjere da smo potvrdili postojanje gotovo svih njegovih teoretiziranih dijelova.
Danas su atomska istraživanja fokusirana na proučavanje strukture i funkcije materije na subatomskoj razini. To se ne sastoji samo u identificiranju svih subatomskih čestica za koje se misli da čine atom, već u istraživanju sila koje njima upravljaju. To uključuje jake nuklearne sile, slabe nuklearne sile, elektromagnetizam i gravitaciju. Evo podataka o kojem smo do sada saznali o atomu ...
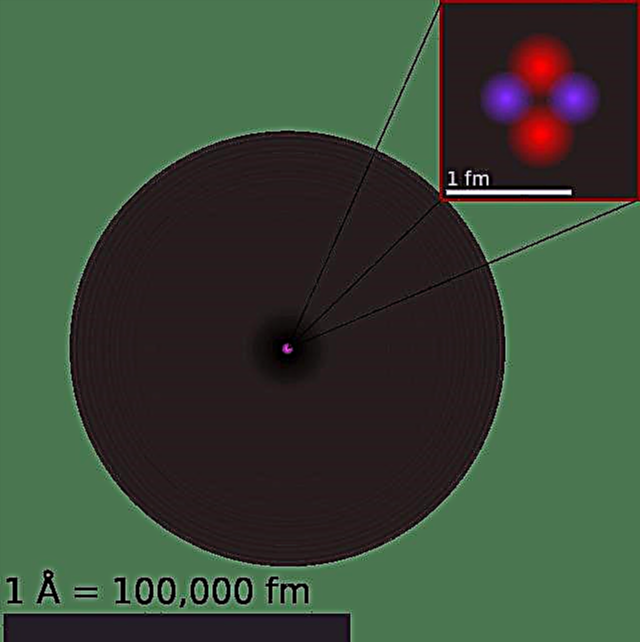
Struktura atoma:
Naš trenutni model atoma može se raščlaniti na tri sastavna dijela - protone, neutron i elektrone. Svaki od ovih dijelova ima pripadajući naboj, pri čemu protoni nose pozitivan naboj, elektroni imaju negativan naboj, a neutroni nemaju neto naboj. U skladu sa Standardnim modelom fizike čestica, protoni i neutroni čine jezgro atoma, dok elektroni kruže u "oblaku".

Elektrone u atomu privlače protoni u jezgri elektromagnetskom silom. Elektroni mogu pobjeći iz svoje orbite, ali samo kao odgovor na vanjski izvor energije koji se primjenjuje. Što je orbita elektrona bliža jezgri, to je veća privlačna sila; dakle, jača je vanjska sila koja je potrebna da bi elektron pobjegao.
Elektroni kruže jezgrom u više orbita, od kojih svaka odgovara određenoj energetskoj razini elektrona. Elektroni mogu promijeniti svoje stanje u višu razinu energije tako što apsorbiraju foton s dovoljno energije da ga potaknu u novo kvantno stanje. Isto tako, elektron u višem energetskom stanju može pasti na niže energetsko stanje dok zrači višak energije kao foton.
Atomi su električno neutralni ako imaju jednak broj protona i elektrona. Atomi koji imaju ili deficit ili višak elektrona nazivaju se ioni. Elektroni koji su najudaljeniji od jezgre mogu se prenijeti u druge obližnje atome ili dijeliti između atoma. Ovim mehanizmom atomi se mogu vezati u molekule i druge vrste kemijskih spojeva.
Sve tri ove subatomske čestice su Fermioni, klasa čestica povezanih s materijom koja je u prirodi ili elementarna (elektroni) ili kompozitna (protoni i neutroni). To znači da elektroni nemaju poznatu unutarnju strukturu, dok se protoni i neutroni sastoje od drugih subatomskih čestica. zvani kvarkovi. Postoje dvije vrste kvarkova u atomima koji imaju frakcijski električni naboj.

Protoni su sastavljeni od dva kvarta "gore" (svaki s nabojem +2/3) i jednog kvarka "dolje" (-1/3), dok se neutroni sastoje od jednog gore kvarka i dva kvarka prema dolje. Ova razlika objašnjava razliku naboja između dvije čestice, koji djeluje do naboja od +1 i 0, dok elektroni imaju naboj -1.
Ostale subatomske čestice uključuju Leptone koji se kombiniraju s Fermionima i tvore gradivne materije. U sadašnjem atomskom modelu postoji šest leptona: čestice elektrona, muona i taua i njihovi pridruženi neutrini. Različite sorte Leptonovih čestica, obično nazvane "okusi", razlikuju se po veličini i naboju, što utječe na razinu njihovih elektromagnetskih interakcija.
Zatim, tu su mjerni bozoni, koji su poznati i kao "nosači sile" budući da posreduju fizičkim silama. Primjerice, gluoni su odgovorni za jaku nuklearnu silu koja drži kvarkove zajedno, dok se za W i Z bozone (još uvijek hipotetički) vjeruje da su odgovorni za slabu nuklearnu silu koja stoji iza elektromagnetizma. Fotoni su osnovna čestica koja čini svjetlost, dok je Higgs Boson odgovoran za davanje W i Z bozona svojoj masi.
Atomska masa:
Većina mase atoma dolazi iz protona i neutrona koji čine njegovo jezgro. Elektroni su najmanje masivne čestice atoma, masa 9.11 x 10-31 kg i veličina premala da bi se mjerila trenutnim tehnikama. Protoni imaju masu koja je 1.836 puta veća od elektrona, 1.6726 × 10-27 kg, dok su neutroni najmasovniji od ta tri, na 1.6929 × 10-27 kg (1.839 puta veća od mase elektrona).

Ukupni broj protona i neutrona u jezgri atoma (zvani „nukleoni“) naziva se masnim brojem. Na primjer, element Carbon-12 je tako nazvan, jer ima masni broj 12 - izveden iz njegovih 12 nukleona (šest protona i šest neutrona). Međutim, elementi su također raspoređeni na temelju njihovih atomskih brojeva, što je isto kao i broj protona koji se nalaze u jezgri. U ovom slučaju, Carbon ima atomski broj 6.
Stvarnu masu atoma u mirovanju vrlo je teško izmjeriti, jer su čak i najmasivniji atomi previše lagani da bi se mogli izraziti u konvencionalnim jedinicama. Kao takvi, znanstvenici često koriste jedinstvenu jedinicu atomske mase (u) - koja se također naziva dalton (Da) - koja je definirana kao dvanaesta masa slobodnog neutralnog atoma ugljika-12, što je otprilike 1,66 × 10-27 kg.
Kemičari također koriste molove, jedinicu definiranu kao jedan mol bilo kojeg elementa koji uvijek ima isti broj atoma (oko 6.022 × 1023). Taj je broj odabran tako da ako element ima atomsku masu od 1 u, mol atoma tog elementa ima masu koja je blizu jednog grama. Zbog definicije jedinstvene jedinice atomske mase, svaki atom ugljika-12 ima atomsku masu od točno 12 u, pa moli ugljiko-12 atoma teže točno 0,012 kg.
Radioaktivno propadanje:
Sva dva atoma koja imaju isti broj protona pripadaju istom kemijskom elementu. Ali atomi s jednakim brojem protona mogu imati različit broj neutrona, koji su definirani kao različiti izotopi istog elementa. Ti su izotopi često nestabilni, a svi oni s atomskim brojem većim od 82 znaju da su radioaktivni.
Kad element propadne, njegovo jezgro gubi energiju emitirajući zračenje - koje se može sastojati od alfa čestica (helijevih atoma), beta čestica (pozitrona), gama zraka (visokofrekventna elektromagnetska energija) i pretvorbenih elektrona. Brzina raspada nestabilnog elementa poznata je kao njegov "poluživot", što je vrijeme potrebno da element padne do polovice početne vrijednosti.
Na stabilnost izotopa utječe omjer protona i neutrona. Od 339 različitih vrsta elemenata koji se prirodno javljaju na Zemlji, 254 (oko 75%) su označeni kao "stabilni izotopi" - tj. Ne podliježu raspadanju. Dodatna 34 radioaktivna elementa imaju poluživot dulji od 80 milijuna godina, a postoje i od ranog Sunčevog sustava (otuda ih zovu i „primordijalni elementi“).
Napokon, poznato je da se dodatnih 51 kratkotrajna elementa javljaju prirodno, kao "kćerki elementi" (tj. Nuklearni nusprodukti) propadanja drugih elemenata (poput radija iz urana). Pored toga, kratkotrajni radioaktivni elementi mogu biti rezultat prirodnih energetskih procesa na Zemlji, poput bombardiranja kozmičkim zrakama (na primjer, ugljik-14, koji se događa u našoj atmosferi).
Povijest studija:
Najraniji poznati primjeri atomske teorije potječu iz drevne Grčke i Indije, gdje su filozofi poput Demokrita postulirali da je sva materija sastavljena od sićušnih, nedjeljivih i neuništiva. Izraz "atom" skovan je u drevnoj Grčkoj i stvorio je školu misli koja je poznata i kao "atomizam". Međutim, ova je teorija bila više filozofski koncept nego znanstveni.
Tek u 19. stoljeću teorija atoma postala je artikulirana kao znanstvena materija, provedeni su prvi eksperimentalni eksperimenti. Na primjer, u ranim 1800-ima, engleski znanstvenik John Dalton koristio je koncept atoma kako bi objasnio zašto su kemijski elementi reagirali na određene vidljive i predvidljive načine.
Dalton je započeo s pitanjem zašto su elementi reagirali u omjerima malih i cjelovitih brojeva, te zaključio da su se te reakcije događale u mnoštvu višestrukih diskretnih jedinica - drugim riječima, atoma. Kroz niz eksperimenata koji uključuju plinove, Dalton je razvio ono što je poznato kao Daltonova atomska teorija, što ostaje jedan od temelja moderne fizike i kemije.
Teorija se svodi na pet premisa: elementi se, u svom najčišćem stanju, sastoje od čestica zvanih atomi; atomi određenog elementa su svi isti, sve do posljednjeg atoma; atomi različitih elemenata mogu se razlikovati po atomskoj masi; atomi elemenata ujedinjuju se u kemijske spojeve; atomi se ne mogu stvoriti ili uništiti kemijskom reakcijom, samo se grupiranje uvijek mijenja.
Krajem 19. stoljeća znanstvenici su počeli teoretizirati da se atom sastoji od više temeljnih cjelina. Međutim, većina se znanstvenika usudila da ova jedinica bude veličine najmanjeg poznatog atoma - vodika. A onda je 1897. godine, kroz niz eksperimenata pomoću katodnih zraka, fizičar J.J. Thompson je objavio da je otkrio jedinicu koja je 1000 puta manja i 1800 puta lakša od atoma vodika.

Njegovi su eksperimenti također pokazali da su identične česticama koje su ispuštane fotoelektričnim učinkom i radioaktivnim materijalima. Naknadni eksperimenti otkrili su da ova čestica provodi električnu struju kroz metalne žice i negativne električne naboje unutar atoma. Zbog toga je čestica - koja je prvobitno nazvana "truplo", kasnije promijenjena u "elektron", nakon što je čestica Georgea Johnstonea Stoneyja predviđena 1874.
Međutim, Thomson je također postulirao da su elektroni raspoređeni po cijelom atomu, što je bilo ujednačeno more pozitivnog naboja. Ovo je postalo poznato kao „model pudinga od šljive“, što će se kasnije pokazati pogrešnim. To se dogodilo 1909. godine, kada su fizičari Hans Gieger i Ernest Marsden (pod vodstvom Ernesta Rutherfoda) izveli svoj eksperiment koristeći metalnu foliju i alfa čestice.
U skladu s Daltonovim atomskim modelom, vjerovali su da će alfa čestice prolaziti ravno kroz foliju s malim progibom. Međutim, mnoge se čestice odbijaju pod kutima većim od 90 °. Kako bi to objasnio, Rutherford je predložio da se pozitivni naboj atoma koncentrira u sićušnom jezgru u središtu.
Godine 1913. fizičar Niels Bohr predložio je model u kojem su elektroni okružili jezgrom, ali to su mogli učiniti samo u ograničenom skupu orbita. Također je predložio da bi elektroni mogli preskočiti između orbita, ali samo u diskretnim promjenama energije koje odgovaraju apsorpciji ili zračenju fotona. Ovo je ne samo rafiniralo predloženi model Rutherforda, već je i potaklo koncept kvantiziranog atoma, pri čemu se materija ponašala u diskretnim paketima.

Razvoj masenog spektrometra - koji koristi magnet za savijanje putanje ionske snope - omogućio je mjerenje mase atoma s povećanom preciznošću. Kemičar Francis William Aston koristio je ovaj instrument da pokaže da izotopi imaju različitu masu. To je zauzvrat slijedio fizičar James Chadwick, koji je 1932. predložio neutron kao način objašnjenja postojanja izotopa.
Tijekom ranog 20. stoljeća, kvantna priroda atoma razvijala se dalje. Godine 1922. njemački fizičari Otto Stern i Walther Gerlach proveli su eksperiment gdje je snop atoma srebra bio usmjeren kroz magnetsko polje, koje je imalo za cilj da podijeli snop između smjera zamaha (ili okretanja) atoma.
Poznat i kao Stern-Gerlachov eksperiment, rezultati su bili da se snop podijelio na dva dijela, ovisno o tome je li spin atoma usmjeren prema gore ili prema dolje. Godine 1926. fizičar Erwin Schrodinger upotrijebio je ideju da se čestice ponašaju poput valova kako bi razvio matematički model koji je elektrone opisao kao trodimenzionalne oblike talasa, a ne kao puke čestice.
Posljedica korištenja valnih oblika za opisivanje čestica je ta što je matematički nemoguće dobiti precizne vrijednosti za položaj i moment čestice u bilo kojem trenutku. Iste godine Werner Heisenberg formulirao je taj problem i nazvao ga "načelom neizvjesnosti". Prema Heisenbergu, za dano točno mjerenje položaja, može se dobiti samo raspon vjerojatnih vrijednosti za zamah, i obrnuto.

U 1930-ima fizičari su otkrili nuklearnu fisiju zahvaljujući eksperimentima Otta Hahna, Lise Meitner i Otta Frischa. Hahnovi eksperimenti uključivali su usmjeravanje neutrona na atome urana u nadi da će stvoriti transuranijski element. Umjesto toga, postupak je okrenuo njegov uzorak urana-92 (Ur92) u dva nova elementa - barij (B56) i kripton (Kr27).
Meitner i Frisch ovjerili su eksperiment i pripisali ga uratima atoma urana kako bi tvorili dva elementa s istom ukupnom atomskom masom, proces koji je također pustio znatnu količinu energije razbijanjem atomskih veza. U godinama koje su uslijedile započela su istraživanja o mogućem naoružavanju ovog procesa (tj. Nuklearnog oružja) i dovela do izgradnje prvih atomskih bombi u SAD-u do 1945. godine.
U pedesetima, razvoj poboljšanih akceleratora i detektora čestica omogućio je znanstvenicima da proučavaju utjecaje atoma koji se kreću velikom energijom. Iz toga je razvijen Standardni model fizike čestica koji je do sada uspješno objasnio svojstva jezgre, postojanje teoretiziranih subatomskih čestica i sile koje upravljaju njihovim interakcijama.
Moderni eksperimenti:
Od druge polovice 20. stoljeća, mnoga su nova i uzbudljiva otkrića vezana uz atomsku teoriju i kvantnu mehaniku. Primjerice, 2012. godine duga potraga za Higgsovim Bosonom dovela je do proboja gdje su istraživači koji rade pri Europskoj organizaciji za nuklearna istraživanja (CERN) objavili svoje otkriće.

Posljednjih desetljeća fizičari su posvetili mnogo vremena i energije razvoju jedinstvene teorije polja (aka. Velika objedinjujuća teorija ili teorija svega). U osnovi, otkad je prvi predložen Standardni model, znanstvenici su pokušali shvatiti kako četiri temeljne sile svemira (gravitacija, jake i slabe nuklearne sile i elektromagnetizam) djeluju zajedno.
Dok se gravitacija može razumjeti korištenjem Einsteinove teorije relativnosti, a nuklearne sile i elektromagnetizam mogu se razumjeti kvantnom teorijom, niti jedna teorija ne može objasniti sve četiri sile koje djeluju zajedno. Pokušaji da se to riješi doveli su do niza predloženih teorija tijekom godina, od teorije struna do kvantne gravitacije petlje. Do danas nijedna od ovih teorija nije dovela do proboja.
Naše razumijevanje atoma dosta je prošlo, od klasičnih modela koji su na njega gledali kao na inertnu krutinu koja mehanički komunicira s drugim atomima, do modernih teorija gdje su atomi sastavljeni od energetskih čestica koje se ponašaju nepredvidivo. Iako je prošlo nekoliko tisuća godina, naše znanje o temeljnoj strukturi čitave materije znatno je napredovalo.
Pa ipak, ostaje mnogo misterija koje tek treba riješiti. Vremenom i stalnim naporima možda ćemo konačno otkriti posljednje preostale tajne atoma. I onda bi moglo biti moguće da će svaka nova otkrića koja postavljamo tek stvoriti više pitanja - a mogu biti i zbunjujuća od onih koja su došla prije!
Za Space Magazine napisali smo mnoge članke o atomu. Evo članka o atomskom modelu Johna Daltona, atomskom modelu Neilsa Bohra, Tko je bio Demokrit i koliko atoma ima u svemiru?
Ako želite više informacija o atomu, pogledajte NASA-in članak o analiziranju sitnih uzoraka, a ovdje je link do NASA-inog članka o atomima, elementima i izotopima.
Također smo snimili i cijelu epizodu Astronomy Cast-a o Atomu. Slušajte ovdje, epizoda 164: Unutrašnjost atoma, epizoda 263: radioaktivno propadanje i epizoda 394: standardni model, bozoni.