Odavno je poznato da sve molekule posjeduju dva jednaka i suprotna naboja odvojena određenom udaljenošću. U slučaju takvih polarnih molekula, središte negativnog naboja ne podudara se sa središtem pozitivnog naboja. Stupanj polarnosti u takvim kovalentnim molekulama može se opisati izrazom Dipole Moment, koji je u osnovi mjera polarnosti u polarnoj kovalentnoj vezi.
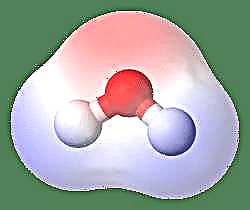
Najjednostavniji primjer dipola je molekula vode. Molekula vode je polarna zbog nejednakog dijeljenja svojih elektrona u "savijenoj" strukturi. Molekula vode tvori kut, s atomima vodika na vrhovima i kisikom u vrhu. Budući da kisik ima veću elektronegativnost od vodika, strana molekule s atomom kisika ima djelomični negativni naboj, dok vodik, u sredini, ima djelomični pozitivni naboj. Zbog toga smjer dipolnog trenutka usmjerava prema kisiku.
Jezikom fizike, električni dipolni moment je mjera odvajanja pozitivnih i negativnih električnih naboja u sustavu naboja, tj. Mjera ukupne polarnosti sustava naboja - tj. Razdvajanje električnog naboja molekula, koji dovodi do dipola. Matematički, i u jednostavnom slučaju dva točkasta naboja, jednog s nabojem + q i drugog s nabojem? Q, električni dipolni moment p može se izraziti kao: p = qd, gdje je d vektor pomaka koji pokazuje od negativnog naboja do pozitivni naboj. Dakle, vektor električnog dipolnog momenta p pokazuje od negativnog na pozitivni naboj.
Drugi način da ga pogledamo je predstavljanje momenta dipola grčkim slovom m, m = ed, gdje je e električni naboj i d je udaljenost razdvajanja. Izražava se jedinicama Debye i piše se D (gdje je 1 Debye = 1 x 10-18e.s.u cm). Trenutak dipola je vektorska količina i stoga je predstavljena malom strelicom s repom u pozitivnom središtu i glavom usmjerenom prema negativnom središtu. U slučaju molekule vode, moment Dipola je 1,85 D, dok je molekula klorovodične kiseline 1,03 D i može se predstaviti kao:
Napisali smo mnogo članaka o dipolskom trenutku za Space Magazine. Evo članka o tome od čega se proizvodi voda, a ovdje je članak o molekulama.
Ako želite više informacija o trenutku dipola, pogledajte ove članke iz časopisa Hyperphysics and Science Daily.
Također smo snimili i cijelu epizodu Astronomy Cast koja govori o molekulama u svemiru. Slušajte ovdje, epizoda 116: Molekule u svemiru.
izvori:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule